|
| | Détermination
de l'acidité totale d'un jus ou d'un vin ©
Copyright : Marc De Brouwer / CEPvdqa
| Pour en savoir plus
sur l'acidité des moûts et des vins et leur détermination (cas
particulier des vins rouges), voyez le traité de
vinification dont sont extraits les principales explications
ci-dessous |
|
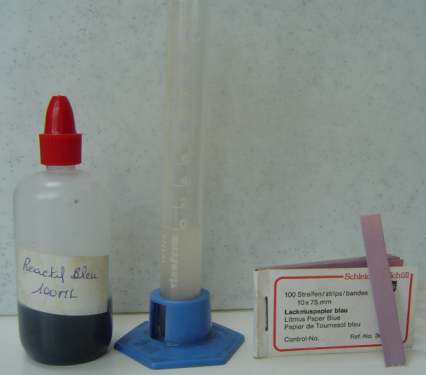
Ci-contre, l'appareillage
nécessaire à la mesure de l'acidité totale d'un moût ou d'un jus.
(il s'agit ici d'un appareillage simple vendu souvent en kit) :
De gauche à
droite :
-
Liquide réactif (solution alcaline de couleur bleue due à la présence
de bleu de bromothymol
qui prend cette couleur entre pH 6 et 7,6)
-
Eprouvette
spécialement graduée,
appelée ACIDOMETRE
-
Papier Tournesol (papier indicateur)
Utiliser toujours
un liquide aussi limpide que possible, filtré au papier filtre pour
enlever les matières solides et permettre une lecture aisée et
précise. |
 |
 |
Remplir
l'éprouvette de jus jusqu'à la graduation 0. Cette quantité de
liquide correspond très précisément à 10 ml. On peut aussi, en
utilisant une pipette de 10 ml, prélever exactement 10 ml de liquide à
analyser.
Attention de bien
lire le niveau du liquide, en tenant compte de la tension superficielle
du liquide. La lecture se fait au-dessous du ménisque (bulle). Chaque
graduation au-dessus du 0 correspond à 1 g d’acidité. La lecture est
directe et facile…
Le jus des photos
est un jus de rhubarbe dont l’acide oxalique a été neutralisé par l’ajout
de 2 g de carbonate de calcium par litre. Son acidité a ainsi chuté de
3 g par rapport à ce qu’elle était au départ. L’acidité de
départ d’un jus de rhubarbe est compris d’environ 14 g (en acide
tartrique), on s’attend à ce que la neutralisation se produise dès
9/10 g
|
 |
 |
 |
 |
 |
| Compléter,
goutte à goutte, par du réactif jusqu'à la graduation 6, par exemple. |
Mélanger intimement le jus et le réactif en retournant 2 à 3 fois
l'éprouvette, auparavant on bouche l'orifice à l'aide du pouce.
La couleur ainsi
obtenue sera jaune. |
On ajoutera du réactif bleu jusqu'à la graduation
suivante : 8,6. |
On mélange à nouveau. |
Et ainsi de suite, jusqu'à ce que
le mélange présente une couleur vert-bleuté ; dans notre
exemple, il marquera la graduation 9: la solution a réagi. |
L'amateur peu
expérimenté et le vinificateur méticuleux peuvent vérifier le moment
exact de la neutralisation en ayant recours au papier tournesol.
Le papier
tournesol est vendu sous forme d'une pochette comprenant une trentaine
de bandelettes de couleur bleu mauve. Lorsqu'une bandelette est en
présence d'un milieu acide, elle vire au rose.
Si le milieu est
basique (ou alcalin) elle reste mauve. Pour vérifier si l'acidité du
vin a été neutralisée, on prend à l'aide d'une pipette par exemple,
une goutte du vin traité et on la dépose sur une bandelette de papier
tournesol.
Si la couleur
vire au rose, il est trop tôt pour lire sur l'éprouvette l'acidité du
vin.
Si la couleur est
plus bleue que mauve, c'est que trop de réactif bleu a été ajouté.
Il est ainsi
aisé de déterminer le moment précis de la neutralisation.
Attention : le
papier tournesol réagit avec l'acidité de l'air due au gaz carbonique
et devient rose à son contact. Il doit être conservé dans un
emballage étanche (boîte, plastique,...). |
 |
 |
La lecture
de l'acidité s'effectue en dessous du ménisque que forme le
liquide avec les bords de l'éprouvette.
Dans le
cas de la mesure d'une acidité, le ménisque est bombé vers le
bas et la lecture se fait par dessous.
La lecture
correcte des photos sera donc de 10,2 (photo de droite - liquide
vu par transparence) et non de 10,4 comme lu à gauche |
 |
| Si vous oubliez
votre éprouvette quelques heures, ne vous étonnez pas de voir la couleur s'éclaircir.
Cela ne signifie pas que l'analyse effectuée plus tôt n'est pas
correcte. Ce phénomène est dû au fait qu'un nouvel équilibre
chimique se produit dans le liquide contenu dans l'éprouvette: certains
acides se dissocient de leurs sels... |
|
Labo Vin
est un site proposant un programme gratuit, utilisable en ligne à
ceux dont la profession ou le hobby est de fabriquer des vins,
vins de fruits, liqueurs... Il leur facilitera le travail en
calculant pour eux rapidement et sans erreur tous les paramètres
qui interviennent dans cette activité : concentrations et
volumes de sucre, d'alcool, mesures d'acidité, de densité... |
|
|












